○ 凯里市第一中学 杨凤香
我们知道,紫色石蕊试液作为酸碱指示剂其中的一种,在中学化学实验中常要用到它。紫色石蕊溶液遇酸性溶液变红色,遇碱性溶液变蓝色。高中化学人教版选修4(第二节水的电离和溶液的酸碱性)P49页资料卡片中提到了石蕊酸碱指示剂的变色原理及范围,对于配制方法没有提及。
查阅大量相关资料,发现对于石蕊的配制方法众说纷纭,总结后发现这样一些问题:一是石蕊颗粒在蒸馏水与无水乙醇中的溶解性如何?二是如何使石蕊溶液呈现紫色?三是石蕊作为常用的指示剂,如果没有呈现紫色的状态,且遇酸性溶液变红,遇碱性溶液变蓝这种明显的显色怎样能担当常用酸碱指示剂呢?
为获得较好的实验效果,我们需寻求紫色石蕊试液最佳的实验配制方法,对此进行了如下的探究。
一、石蕊试液的变色原理
石蕊是一种很弱的有机酸,在溶液中存在电离平衡,而其分子与电离出来的离子呈不同的颜色,因此,PH改变时,由于分子、离子含量的变化,会引起溶液颜色变化。它的变色范围是pH=5.0~8.0之间。也就是说,在溶液中,遇酸,变红PH≤4.5;遇弱酸、中性、弱碱,不变色4.5
二、石蕊试液的配制方法的实验探究
实验准备——
主要仪器PH计,其他仪器省略。配制以下浓度的溶液用以检测或配制成的石蕊溶液。 PH=1的盐酸溶液、PH=3的醋酸溶液、PH=4.4的盐酸溶液、PH=7的Na2SO4溶液、PH=5.4的NaHCO3溶液、PH=13的NaOH溶液、PH=5.3的饱和CO2水溶液、PH=12的氨水溶液。[以上溶液除饱和CO2水溶液外其他的浓度都为0.1 mol/L(下同)]
实验过程——
对比1:石蕊固体在蒸馏水与无水乙醇中的溶解性比较。
说明:几种常规方法中,既有用蒸馏水来溶解石蕊固体颗粒的,也有用无水乙醇来溶解的。就石蕊的溶解性做一组对比实验。
分别称取1g石蕊固体颗粒,置于100ml蒸馏水和100ml无水乙醇,搅拌使之快速溶解。经加热煮沸,静置一夜,过滤将滤渣蒸干,得到的溶液备用。
实验现象——
(1)蒸馏水组:溶液迅速变成深蓝色,加热煮沸静置后一夜过滤后溶液深蓝色偏紫,将滤渣蒸干,得到0.8g滤渣。
(2)无水乙醇组:石蕊颗粒在无水乙醇中基本不溶解,且呈悬浊液状,加热煮沸,发现溶液慢慢变成了淡紫色。静置后过滤溶液呈淡紫色,将滤渣蒸干,得到0.98g滤渣。
结论:石蕊固体部分溶于水,不溶于冷的无水乙醇,热的无水乙醇中有些许溶解但颜色太淡弃用。
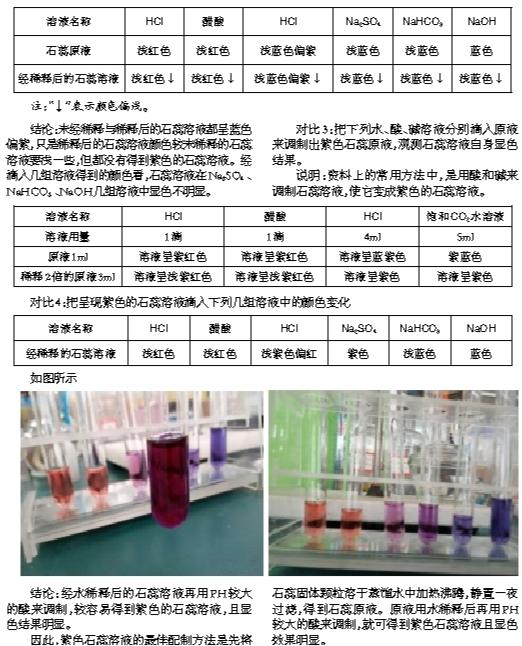
对比2:未用蒸馏水稀释的石蕊溶液与用蒸馏水稀释的石蕊溶液滴入下列几组溶液的颜色变化(取用溶于水的石蕊过滤后得到的溶液,也称原液)。
说明:查阅资料的方法中,有直接用原液使用,也有用水稀释后使用的,故将两组实验作对比。