○ 施秉县第一中学 闫 杨
电化学内容是历年高考中的常考题型,几乎每年每套试卷中都有涉及。虽以电化学基础知识为前提,但对学生分析、灵活解答问题的能力有一定要求,导致很多学生在学习过程中感觉吃力,解题上也不得要领。其实电化学试题中常固定考查几类典型问题,加以分析后可总结出解题的思路和规律方法,指导同学们在作答时有“迹”可循。
一、命题角度
电化学知识常以新型化学电源、燃料电池、微生物电池为载体,考查新情境下原电池原理和电解池原理的应用,在题目中比较常见的问题有电极判断、溶液中离子的移动方向、电极反应式书写、电解液PH变化及电化学反应中定量计算等。
二、解答电化学问题的思维模式
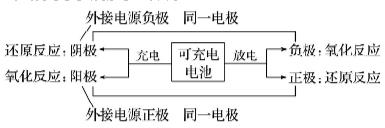
1.图解可充电电池的充放电时两极判断
2.可充电电池的充放电规律
(1)充电时电极的连接:充电的目的是使电池恢复其供电能力,因此负极应与电源的负极相连以获得电子,可简记为负接负后作阴极,正接正后作阳极。
(2)工作时的电极反应式:同一电极上的电极反应式,在充电与放电时形式上恰好是相反的;同一电极周围的溶液,充电与放电时PH的变化趋势也恰好相反。
3.对溶液中离子的移动方向判断
放电时,阴离子向负极移,阳离子向正极移(可记为离子带什么电荷则往哪极移);
充电时,阴离子向阳极移,阳离子向阴极移(可记为阴阳相吸引)。
4. 可充电电池电极反应式的书写策略
一般都是先书写放电的电极反应式。分为三步:第一,先标出原电池总反应式电子转移的方向和数目,指出参与负极和正极反应的物质;第二,写出一个比较容易书写的电极反应式(书写时一定要注意电极产物是否与电解质溶液共存);第三,在电子守恒的基础上,总反应式减去写出的电极反应式即得另一电极反应式。充电时的电极反应与放电的电极反应过程相反,充电的阳极反应为放电正极反应的逆过程,充电的阴极反应为放电负极反应的逆过程。
5.有关定量计算方法
电化学题目中的计算常见两极产物的定量计算,电量与产物之间的相互计算等。 可根据电极反应或总反应式中的比例关系列式计算或依据电路中得失电子守恒建立已知量与未知量之间的桥梁,列出计算所需的关系式。
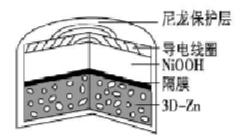
【例1】 [2019新课标]为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状[~公式~]可以高效沉积[~公式~]的特点,设计了采用强碱性电解质的[~公式~]二次电池,结构如上图所示。电池反应为[~公式~]下列说法错误的是
A.三维多孔海绵状[~公式~]具有较高的表面积,所沉积的[~公式~]分散度高
B.充电时阳极反应为[~公式~]
C.放电时负极反应为[~公式~]
D.放电过程中[~公式~]通过隔膜从负极区移向正极区
【点评】本题给出总反应式可以通过先标出放电或充电时总反应式电子转移的方向和数目,结合电化学原理重点分析出选项中反应物,对应产物及结合离子移动方向电解质环境是否符合。
【解析】B项,充电时相当电解池,根据化合价的变化阳极失电子发生氧化反应,根据总反应式可知阳极是[~公式~]失去电子转化为[~公式~],而[~公式~]移向阳极参与反应符合规律, B正确;C项,放电时相当于是原电池,负极失去电子化合价升高,发生氧化反应式,根据总反应式可知[~公式~]失去[~公式~] 变为[~公式~],而[~公式~]移向负极参与反应符合规律,C正确;D项,根据规律放电过程原电池中阴离子向负极移动,则[~公式~]通过隔膜从正极区移向负极区,D错误。
三、新型燃料电池解题思维要点
1.寻找氧气或者空气端,该端永远为正极,通入燃料的一极为负极;
2.通过介质中离子的移动方向,可以判断电池的正、负极,同时考虑该离子是否参与靠近一极的电极反应;
3.注意介质的成分,对于熔融状态介质,其环境都是高温,若环境中如果有酶、微生物、环境不能是高温,否则失活;
4.记住四种介质下正极的电极反应式:酸性:[~公式~];碱性:[~公式~];熔融状态碳酸盐:[~公式~];固体氧化物:[~公式~]。
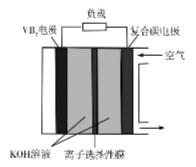
【例2】(2020·新课标Ⅲ卷)一种高性能的碱性硼化钒[~公式~]—空气电池如下图所示,其中在[~公式~]电极发生反应:[~公式~],该电池工作时,下列说法错误的是
A.负载通过0.04 mol电子时,有0.224 L(标准状况)[~公式~]参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为
[~公式~]
D.电流由复合碳电极经负载、[~公式~]电极、[~公式~]溶液回到复合碳电极
【点评】根据电极处的通入物和产物判断电极是解题的关键,若判断错误将导致整个题目的后续判断都将错误。结合燃料电池电极确定方法,图中空气的一极为正极,结合电解质[~公式~]可以得正极反应式为[~公式~],从而分析出ABC选项。
【解析】A项,电子与氧气计量系数为4∶1,通过0.04mol电子则消耗0.01mol氧气,在标况下为0.224L,A正确;B项,反应过程中正极生成大量的[~公式~]使正极区pH升高,负极消耗[~公式~]则pH降低,B错误;C项,根据得出的正极反应式,将两极得失电子数配平,正负极反应式相加得出电池的总反应方程式为[~公式~],C正确;D项,电池中,电子由[~公式~]电极经负载流向复合碳电极,电流流向与电子流向相反,则电流流向为复合碳电极→负载→[~公式~]电极→[~公式~]溶液→复合碳电极,D正确。